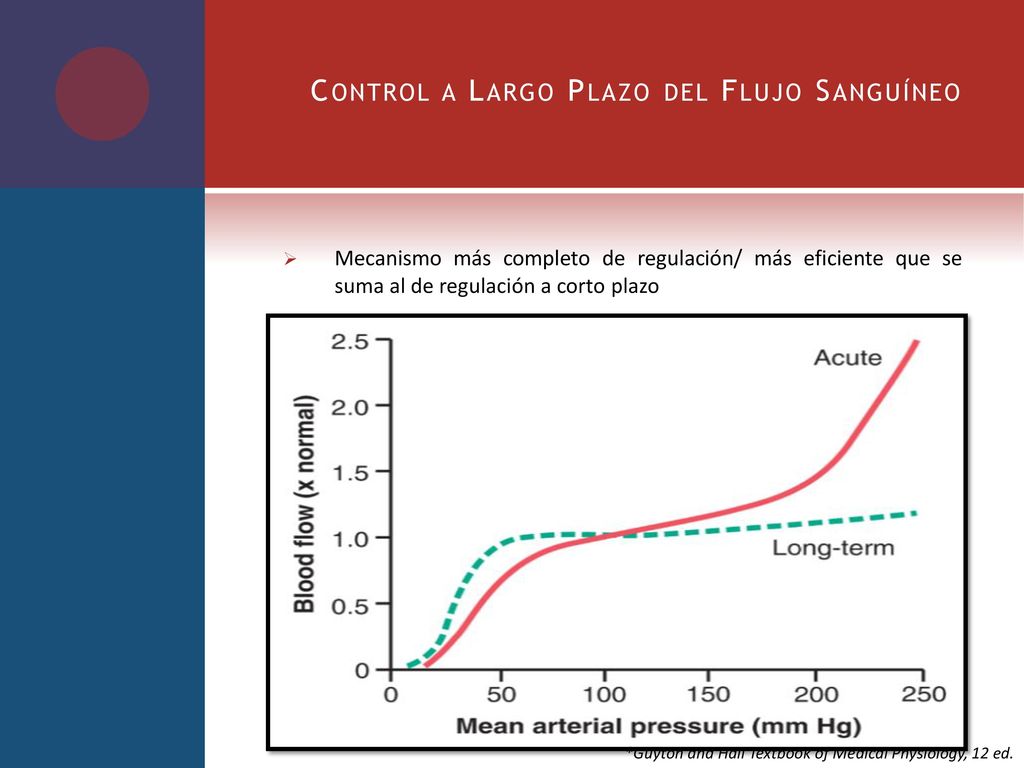
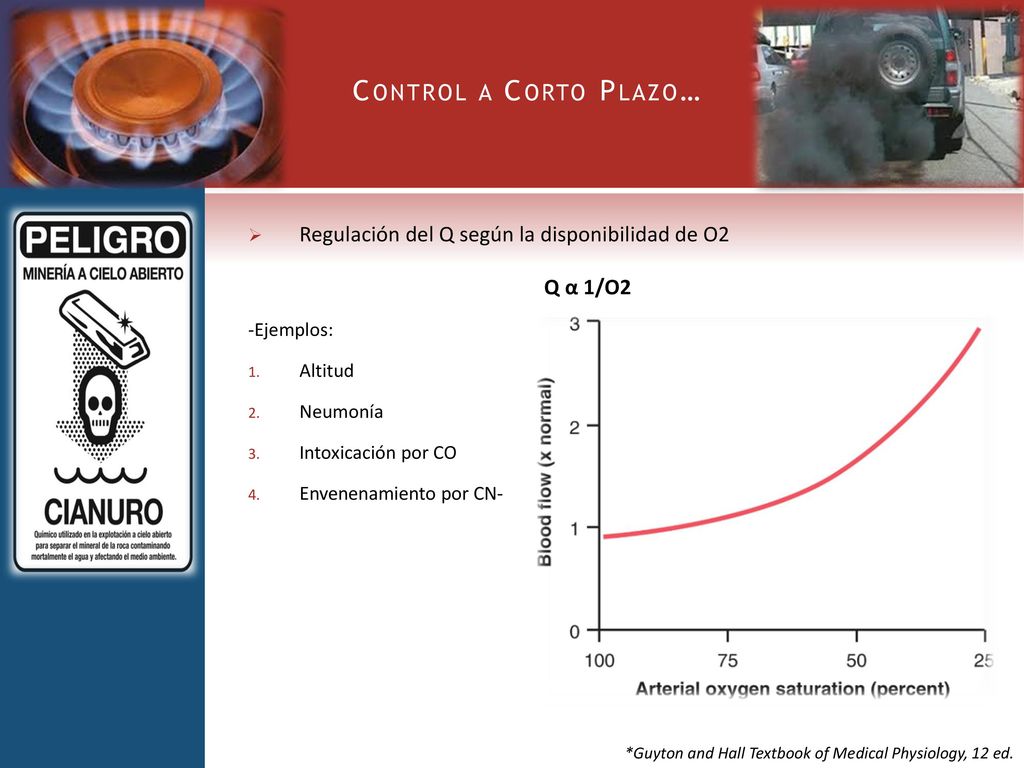
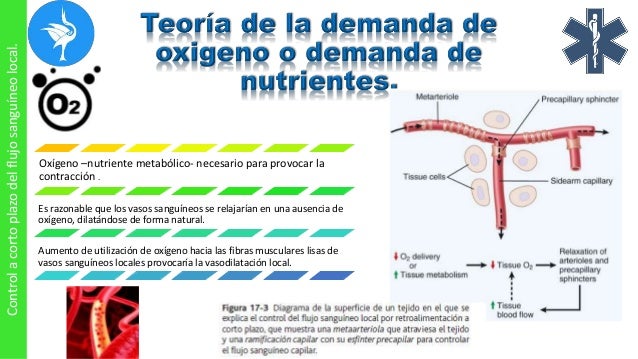
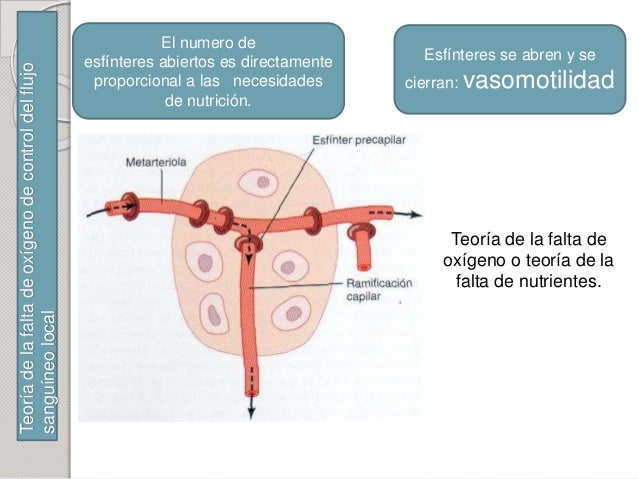
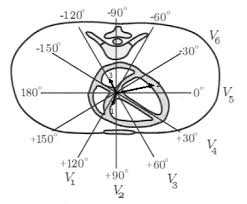
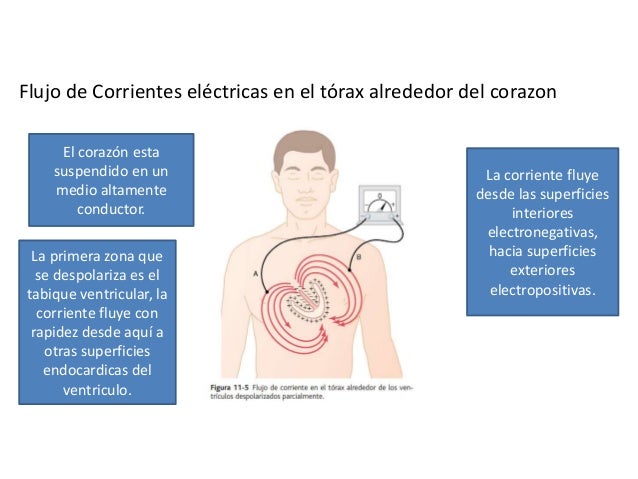
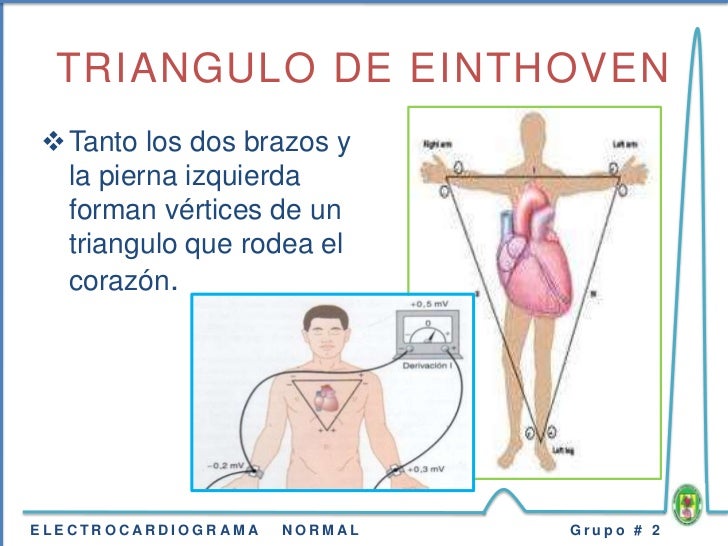
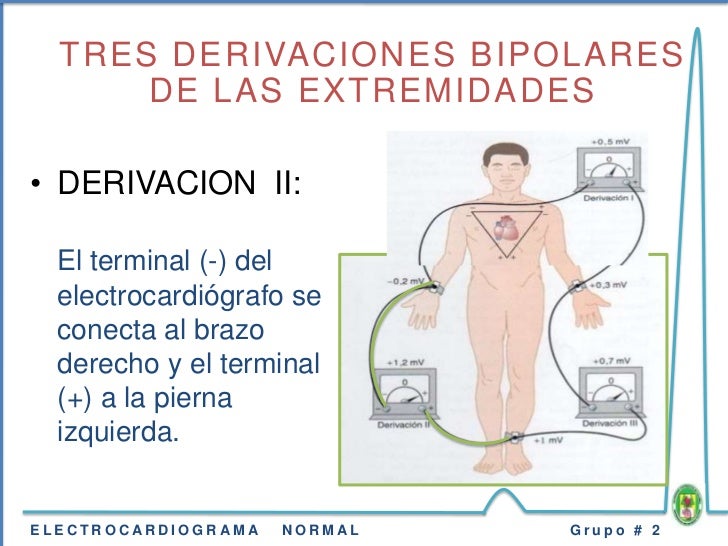
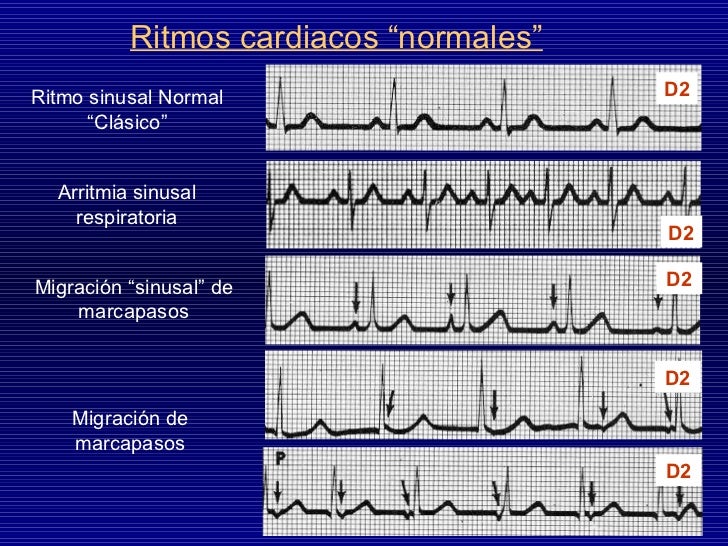
Sistema nervioso autónomo
Con diferencia, la parte más importante del sistema nervioso autónomo para la regulación de la circulación es el sistema nervioso simpático. No obstante, el sistema nervioso parasimpático contribuye de manera importante a la regulación de la función cardíaca
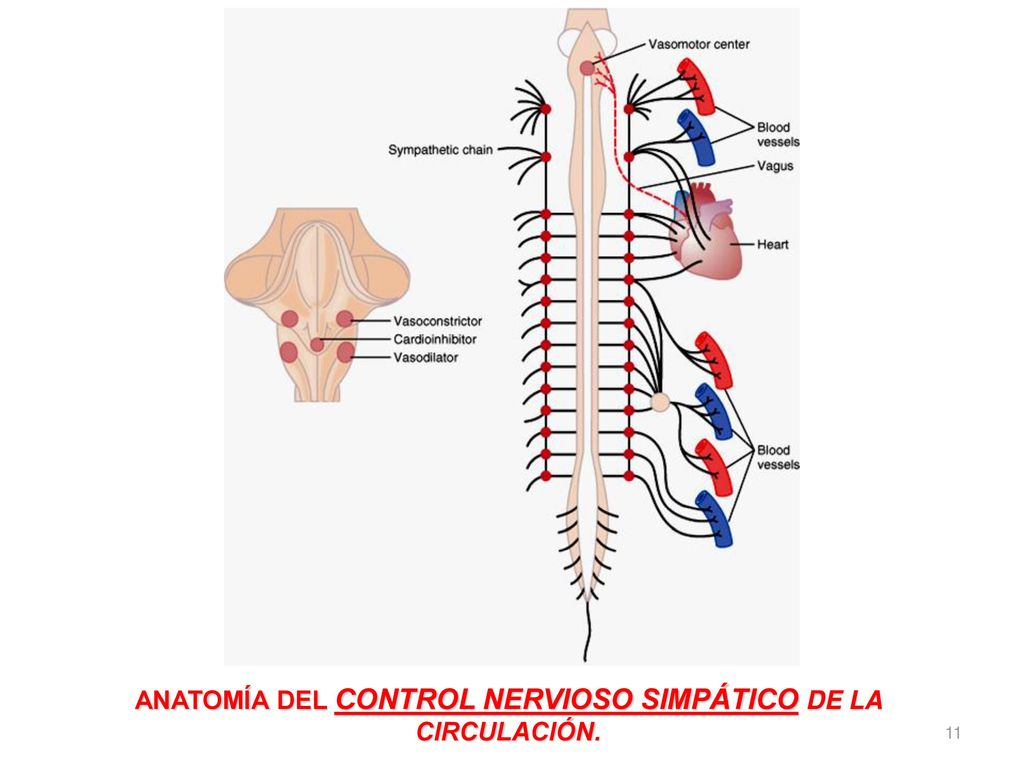
Las fibras nerviosas vasomotoras salen de la médula espinal a través de los nervios de la columna torácica y de los primeros uno o dos nervios lumbares. A continuación, pasan inmediatamente hacia las cadenas simpáticas, cada una de las cuales recorre cada lado de la columna vertebral. Después, siguen dos rutas hacia la circulación:
1) a través de los nervios simpáticos específicos que inervan principalmente la vasculatura de las vísceras internas y del corazón.
2) entrando casi inmediatamente en las porciones periféricas de los nervios espinales que se distribuyen hacia la vasculatura de las zonas periféricas. Las vías precisas que siguen esas fibras en la médula espinal y en las cadenas simpáticas.
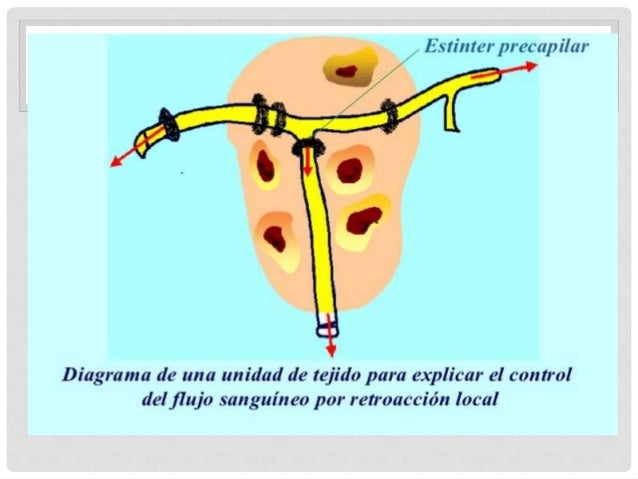
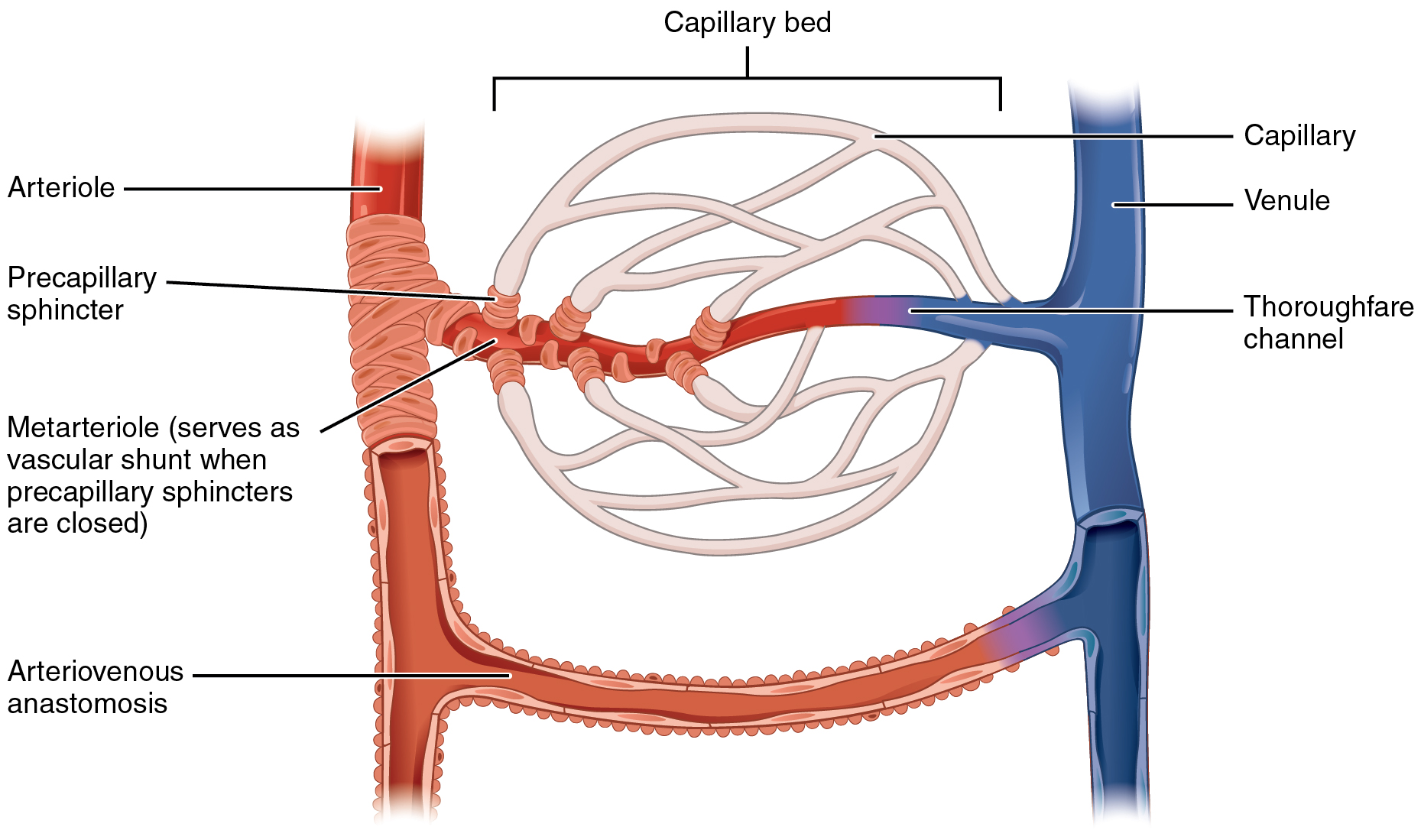
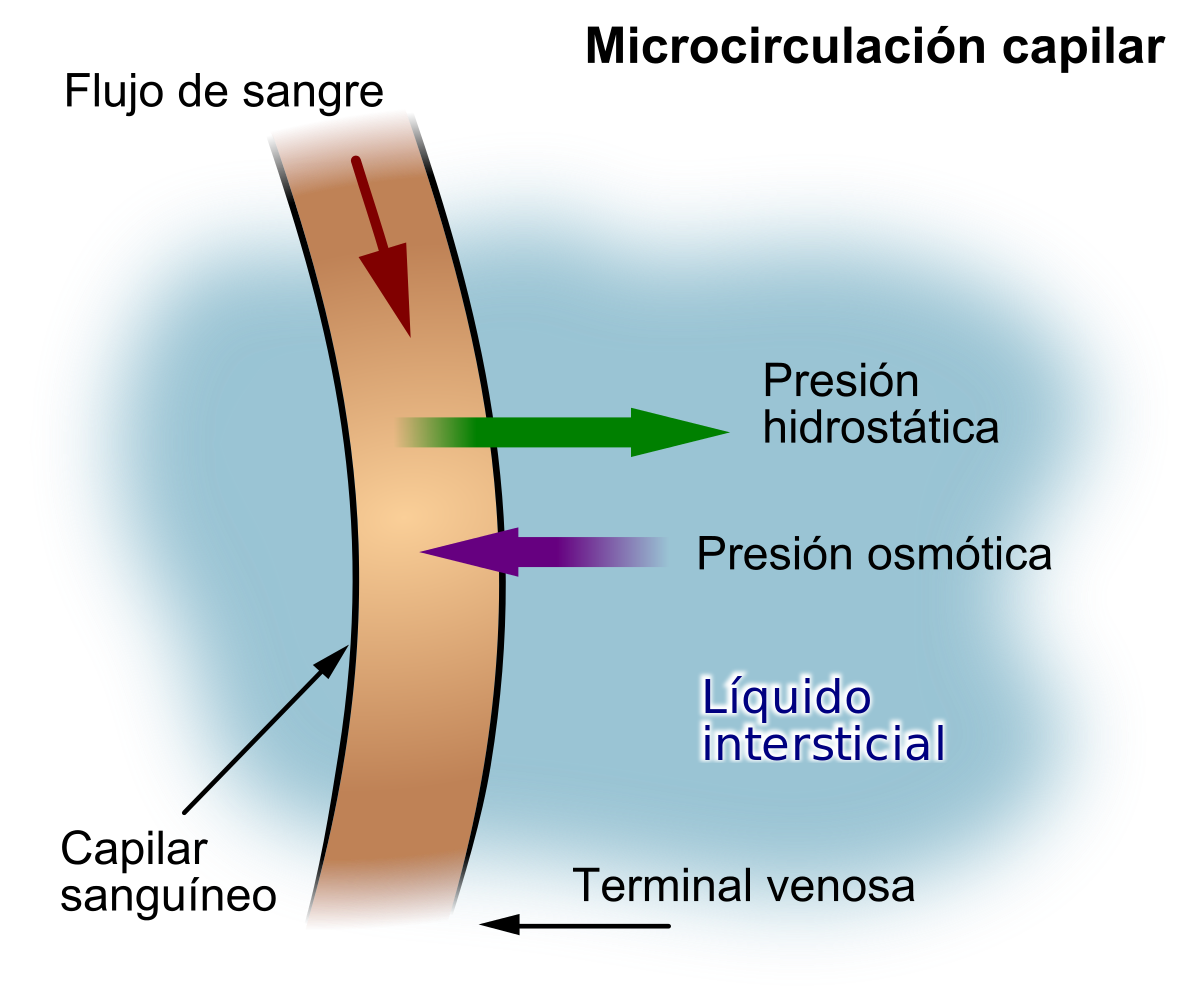
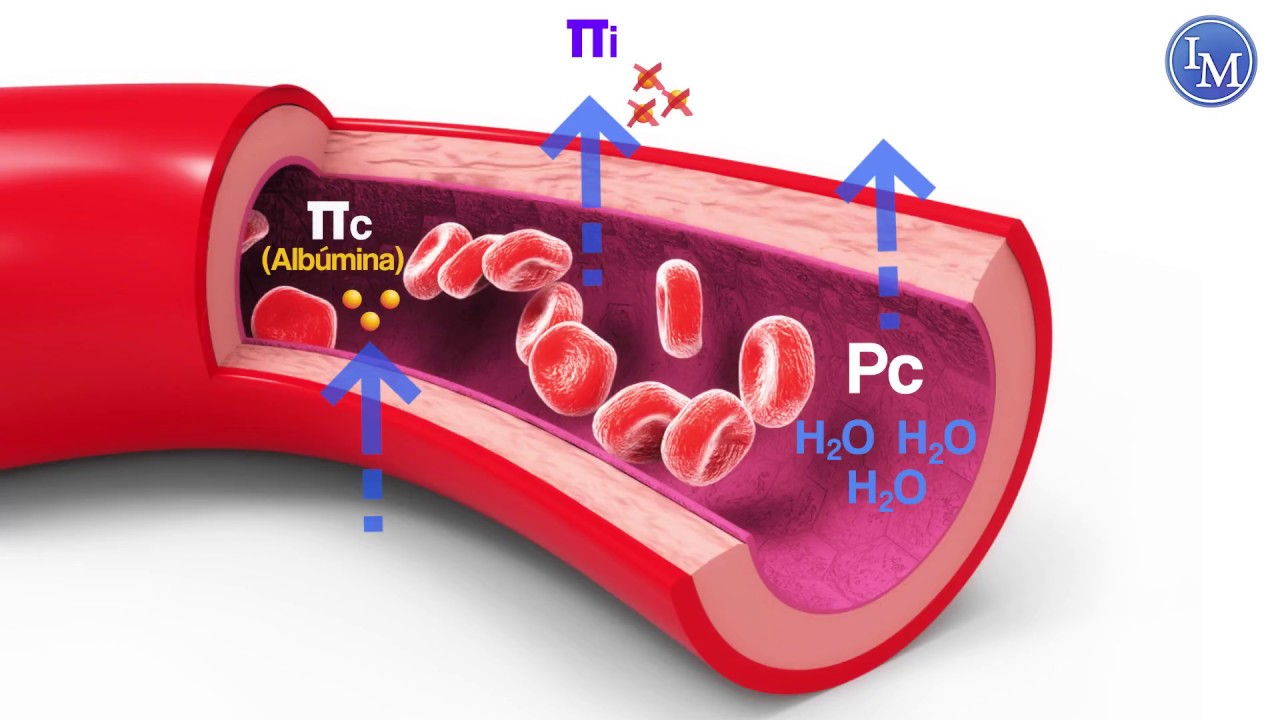
Los esfínteres precapilares y las metaarteriolas están inervados en algunos tejidos como los vasos sanguíneos mesentéricos, aunque normalmente su inervación simpática no es tan densa como en las pequeñas arterias, las arteriolas y las venas.
La inervación de las pequeñas arterias y arteriolas permite que la estimulación simpática aumente la resistencia al flujo sanguíneo y, por tanto, disminuya la velocidad del flujo sanguíneo a través de los tejidos. La inervación de los vasos grandes, en particular de las venas, hace posible que la estimulación simpática disminuya el volumen de estos vasos. Esta disminución del volumen empuja la sangre hacia el corazón y, por tanto, desempeña un papel muy importante en la regulación de la función.


Los nervios simpáticos transportan una enorme cantidad de fibras nerviosas vasoconstrictoras y solo algunas fibras vasodilatadoras. Las fibras vasoconstrictoras se distribuyen esencialmente hacia todos los segmentos de la circulación, pero más hacia algunos tejidos que otros. Este efecto vasoconstrictor simpático es especialmente potente en los riñones, intestinos, bazo y piel, pero lo es mucho menos en el músculo esquelético y el cerebro.
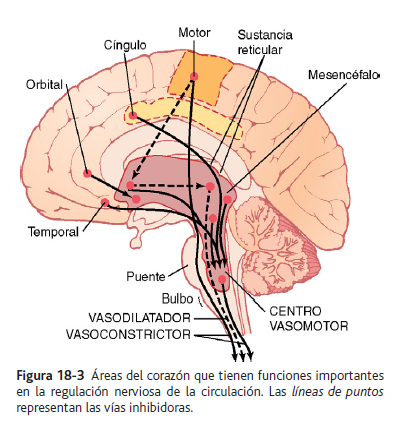
Aunque la organización total del centro vasomotor aún no se conoce con detalle, en algunos experimentos ha sido posible identificar ciertas zonas importantes en este centro: 1. Una zona vasoconstrictora situada bilateralmente en las porciones anterolaterales de la parte superior del bulbo. Las neuronas que se originan en esta zona distribuyen sus fibras a todos los niveles de la médula espinal, donde excitan las neuronas vasoconstrictoras preganglionares del sistema nervioso simpático. 2. Una zona vasodilatadora situada bilateralmente en las porciones anterolaterales de la mitad inferior del bulbo. Las fibras de estas neuronas se proyectan hacia arriba, hacia la zona vasoconstrictora que acabamos de describir, e inhiben la actividad vasoconstrictora de esta zona, con lo que provocan vasodilatación. 3. Una zona sensitiva situada bilateralmente en el núcleo del tracto solitario de las porciones posterolaterales del bulbo y parte inferior de la protuberancia. Las neuronas de esa zona reciben señales nerviosas sensitivas desde el sistema circulatorio, principalmente a través de los nervios vagos y glosofaríngeos, y emiten señales eferentes desde esta zona sensitiva que facilitan las actividades de
control de las zonas tanto vasoconstrictoras como vasodilatadoras, con lo que se consigue el control «reflejo» de muchas funciones circulatorias. Un ejemplo es el reflejo de barorreceptores para controlar la presión arterial, que se describe más adelante en este capítulo.
Función del sistema nervioso en el control rápido de la presión arterial
Una de las funciones más importantes del control nervioso de la circulación es su capacidad de provocar incrementos rápidos de la presión arterial. Para tal fin, todas las funciones vasoconstrictoras y cardioaceleradoras del sistema nervioso simpático se estimulan a la vez y, al mismo tiempo, se produce una inhibición recíproca de las señales inhibidoras vagales parasimpáticas hacia el corazón. Es decir, se producen tres cambios importantes simultáneamente, cada uno de los cuales aumenta la presión arterial, que son los siguientes:
1. La mayoría de las arteriolas de la circulación sistémica se contraen, lo que aumenta mucho la resistencia periférica total y, en consecuencia, la presión arterial.
2. Las venas, en especial (aunque también los demás vasos grandes de la circulación), se contraen con fuerza. Esta contracción desplaza la sangre desde los grandes vasos sanguíneos periféricos hacia el corazón, con lo que aumenta el volumen de sangre en las cámaras cardíacas. El estiramiento del corazón provoca entonces un latido más potente de este órgano y, por tanto, el bombeo de mayores cantidades de sangre. Además, aumenta la presión arterial.
3. Por último, el sistema nervioso autónomo estimula directamente al corazón, lo que también potencia la bomba cardíaca. Gran parte de este incremento del bombeo cardíaco se debe al aumento de la frecuencia cardíaca, a veces hasta tres veces con respecto a lo normal. Además, las señales nerviosas simpáticas tienen un efecto directo significativo que aumenta la fuerza contráctil del músculo cardíaco, lo cual aumenta la capacidad del corazón de bombear mayores volúmenes de sangre. Durante una estimulación simpática potente el corazón puede bombear aproximadamente dos veces la misma cantidad de sangre que en condiciones normales, lo que contribuye aún más al aumento agudo de la presión arterial.
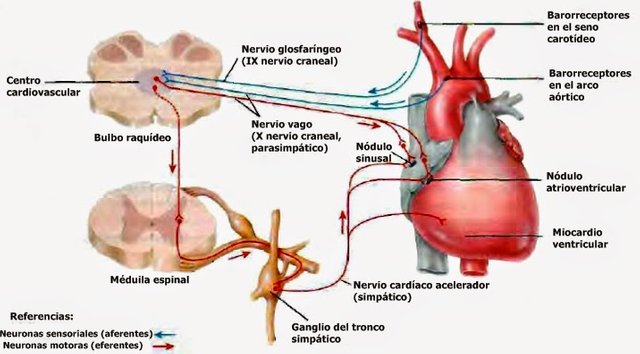
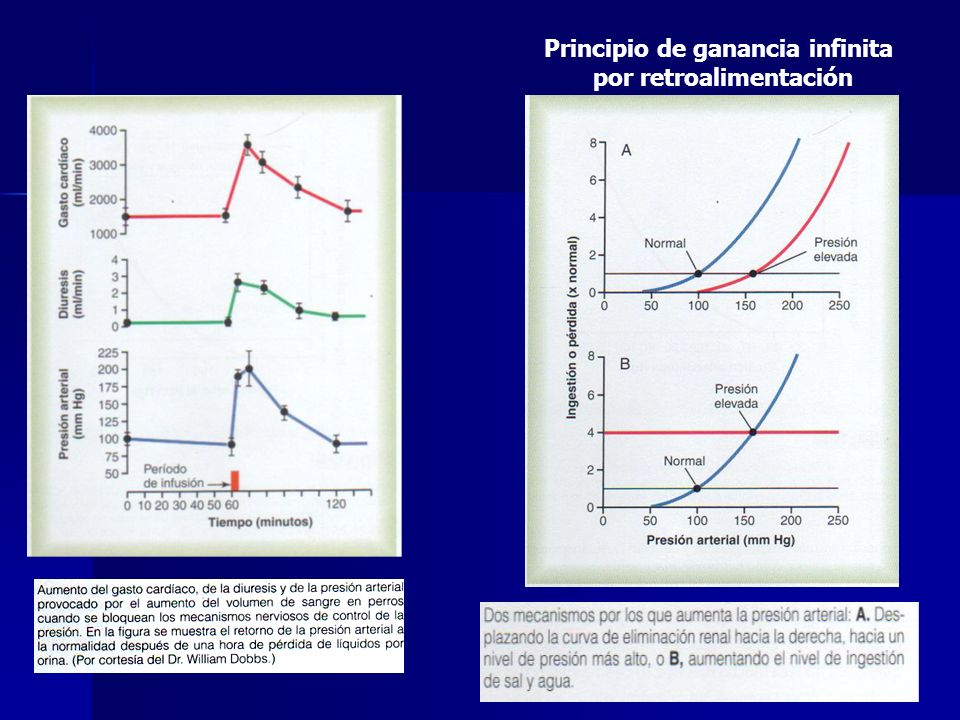
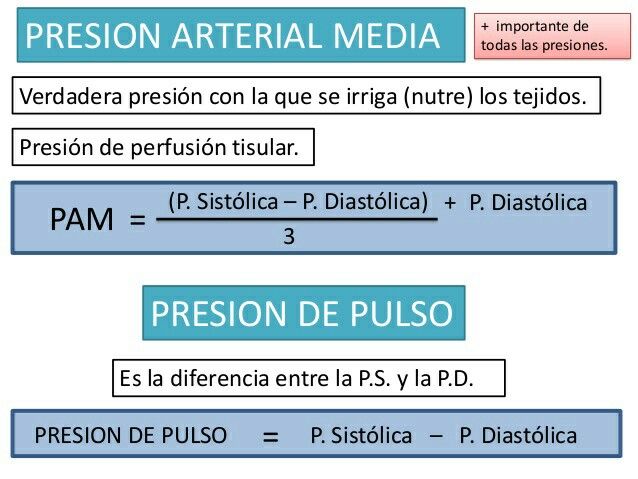
Con mucho, los mecanismos nerviosos mejor conocidos para el control de la presión arterial es el reflejo barorreceptor. Básicamente, este reflejo se inicia en los receptores de estiramiento, conocidos como barorreceptores o presorreceptores, situados en puntos específicos de las paredes de varias arterias sistémicas de gran tamaño. El aumento de la presión arterial estira los barorreceptores y hace que transmitan las señales hacia el SNC. Las señales de «retroalimentación» vuelven después a través del sistema nervioso autónomo hacia la circulación para reducir la presión arterial hasta el nivel normal, los «barorreceptores carotídeos» se transmiten a través de los pequeños nervios de Hering, hacia los nervios glosofaríngeos de la parte alta del cuello y después hacia el núcleo del tracto solitario de la zona del bulbo en el tronco del encéfalo. Las señales que proceden de los «barorreceptores aórticos» del cayado aórtico se transmiten a través de los nervios vagos hacia el núcleo del tracto solitario del bulbo.
La capacidad de los barorreceptores de mantener una presión arterial relativamente constante en la parte superior del cuerpo es importante cuando una persona se levanta después de haber estado tumbada. Inmediatamente la presión arterial de la cabeza y parte superior del cuerpo tiende a caer y el descenso importante de esta presión podría provocar la pérdida de conciencia, aunque el descenso de la presión en los barorreceptores provoca un reflejo inmediato que da lugar a una descarga simpática potente en todo el cuerpo, lo que minimiza el descenso de la presión en la cabeza y la parte superior del cuerpo.
Respuesta isquémica del sistema nervioso central: control de la presión arterial por el centro vasomotor del cerebro en respuesta a un descenso del flujo sanguíneo cerebral
La mayor parte del control nervioso de la presión sanguínea se logra por los reflejos que se originan en los barorreceptores, los quimiorreceptores y los receptores de presión baja, todos ellos situados en la circulación periférica fuera del cerebro. No obstante, cuando el flujo sanguíneo que se dirige hacia el centro vasomotor en la parte inferior del tronco del encéfalo disminuye lo suficiente para provocar un defecto nutricional, es decir, para provocar la isquemia cerebral, las neuronas vasoconstrictoras y cardioaceleradoras del centro vasomotor responden directamente a la isquemia y se excitan con fuerza. Cuando se produce esta excitación, la presión arterial sistémica aumenta hasta los niveles máximos que pueda bombear el corazón. Se cree que este efecto se debe al fracaso de la sangre que fluye lentamente y no puede llevarse el dióxido de carbono del centro vasomotor del tronco del encéfalo. Con niveles bajos de flujo sanguíneo hacia el centro vasomotor, la concentración local de dióxido de carbono aumenta mucho y tiene un efecto muy potente para estimular las zonas de control vasomotor nervioso simpático en el bulbo raquídeo. Es posible que haya otros factores, como la acumulación de ácido láctico y de otras sustancias ácidas en el centro vasomotor, que también contribuyen a la importante estimulación y elevación de la presión arterial. Esta elevación en respuesta a una isquemia cerebral se conoce como respuesta isquémica del SNC. El efecto isquémico sobre la actividad vasomotora puede elevar drásticamente la presión arterial media, llegando incluso a los 250 mmHg durante hasta 10 min. El grado de vasoconstricción simpática provocado por la isquemia cerebral intensa a menudo es tan grande que algunos de los vasos periféricos se ocluyen total o casi totalmente. Por ejemplo, los riñones interrumpen totalmente su producción de orina por la constricción arteriolar renal en respuesta a la descarga simpática. Por tanto, la respuesta isquémica del SNC es uno de los activadores más potentes de todos los activadores del sistema vasoconstrictor simpático.
Características especiales del control nervioso de la presión arterial
Función de los nervios y músculos esqueléticos en el incremento del gasto cardíaco y la presión arterial
Aunque el control nervioso de la circulación de acción más rápida se efectúa a través del sistema nervioso autónomo, hay al menos dos situaciones en las que los nervios y músculos esqueléticos también tienen un papel importante en las respuestas circulatorias. Reflejo de compresión abdominal Cuando se provoca un reflejo de barorreceptores o quimiorreceptores, las señales nerviosas se transmiten simultáneamente a través de los nervios esqueléticos hacia los músculos esqueléticos del organismo, en particular hacia los músculos abdominales.
La contracción muscular comprime todos los reservorios venosos del abdomen, ayudando a trasladar la sangre desde los reservorios vasculares abdominales hacia el corazón.
En consecuencia, el corazón dispone de una mayor cantidad de sangre para bombear. Esta respuesta global se conoce como reflejo de compresión abdominal. El efecto resultante sobre la circulación es el mismo que el causado por los impulsos vasoconstrictores simpáticos cuando contraen las venas: aumento del gasto cardíaco y aumento de la presión arterial. Es probable que el reflejo de compresión abdominal sea más importante de lo que se pensaba en el pasado, porque es bien sabido que las personas cuyos músculos esqueléticos se han paralizado son mucho más propensas a sufrir episodios de hipotensión que las personas con músculos esqueléticos normales.
Aumento del gasto cardíaco y de la presión arterial causado por la contracción del músculo esquelético durante el ejercicio
Cuando los músculos esqueléticos se contraen durante el ejercicio comprimen los vasos sanguíneos por todo el organismo. Incluso la anticipación del ejercicio aprieta los músculos, con lo que se comprimen los vasos musculares y abdominales. Esta compresión traslada sangre desde los vasos periféricos hacia el corazón y los pulmones y, por tanto, aumenta el gasto cardíaco. Este efecto es esencial como ayuda para provocar un incremento del gasto cardíaco en 5-7 veces, como sucede a veces durante el ejercicio intenso. A su vez, el aumento del gasto cardíaco es un componente esencial del incremento de la presión arterial durante el ejercicio, un incremento que suele partir de una media normal de 100 mmHg hasta 130-160 mmHg.
Ondas respiratorias en la presión arterial
Con cada ciclo de respiración la presión arterial aumenta y cae 4-6 mmHg en forma de oleadas, provocando las ondas respiratorias de la presión arterial. Las ondas son consecuencia de varios efectos, algunos de los cuales tienen un origen reflejo: 1. Muchas de las «señales respiratorias» que surgen en el centro de la respiración del bulbo se «desbordan» hacia el centro vasomotor con cada ciclo respiratorio. 2. Cada vez que una persona inspira la presión de la cavidad torácica se vuelve más negativa de lo
habitual, provocando la expansión de los vasos sanguíneos torácicos y reduciendo, en consecuencia, la cantidad de sangre que vuelve hacia el corazón izquierdo y disminuyendo momentáneamente el gasto cardíaco y la presión arterial. 3. Los cambios de presión provocados en los vasos torácicos por la respiración excitan los receptores de estiramiento vasculares y auriculares. Aunque es difícil analizar las relaciones exactas de todos estos factores al provocar las ondas de presión respiratorias, el resultado neto durante la respiración normal es un aumento de la presión arterial durante la parte precoz de la espiración y un descenso de la presión durante el resto del ciclo respiratorio. Durante la respiración profunda la presión sanguínea aumenta y disminuye hasta 20 mmHg con cada ciclo respiratorio.
Ondas respiratorias en la presión arterial Con cada ciclo de respiración la presión arterial aumenta y cae 4-6 mmHg en forma de oleadas, provocando las ondas respiratorias de la presión arterial. Las ondas son consecuencia de varios efectos, algunos de los cuales tienen un origen reflejo: 1. Muchas de las «señales respiratorias» que surgen en el centro de la respiración del bulbo se «desbordan» hacia el centro vasomotor con cada ciclo respiratorio. 2. Cada vez que una persona inspira la presión de la cavidad torácica se vuelve más negativa de lo
habitual, provocando la expansión de los vasos sanguíneos torácicos y reduciendo, en consecuencia, la cantidad de sangre que vuelve hacia el corazón izquierdo y disminuyendo momentáneamente el gasto cardíaco y la presión arterial. 3. Los cambios de presión provocados en los vasos torácicos por la respiración excitan los receptores de estiramiento vasculares y auriculares. Aunque es difícil analizar las relaciones exactas de todos estos factores al provocar las ondas de presión respiratorias, el resultado neto durante la respiración normal es un aumento de la presión arterial durante la parte precoz de la espiración y un descenso de la presión durante el resto del ciclo respiratorio. Durante la respiración profunda la presión sanguínea aumenta y disminuye hasta 20 mmHg con cada ciclo respiratorio.
A menudo, mientras se registra la presión arterial, además de las pequeñas ondas de presión causadas por la respiración se observan otras ondas mucho mayores, a veces hasta de 10-40 mmHg, que aumentan y disminuyen más lentamente que las ondas respiratorias. La duración de cada ciclo varía de 26 s en el perro anestesiado a 7-10 s en un ser humano no anestesiado. Estas ondas se denominan ondas vasomotoras u ondas de Mayer.